Allosteric role of a structural NADP+ molecule in glucose-6-phosphate dehydrogenase activity.
- 임지현
- 1월 27일
- 4분 분량
논문 제목 : Allosteric role of a structural NADP+ molecule in glucose-6-phosphate dehydrogenase activity.
저자명 : Xuepeng Wei, Kathryn Kixmoeller c, Elana Baltrusaitis c, Xiaolu Yang d, Ronen Marmorstein
Publish : 2022, Jul 12
DOI : https://doi.org/10.1073/pnas.2119695119
Abstract : Human glucose-6-phosphate dehydrogenase (G6PD) is the main cellular source of NADPH, and thus plays a key role in maintaining reduced glutathione to protect cells from oxidative stress disorders such as hemolytic anemia. G6PD is a multimeric enzyme that uses the cofactors β-D-glucose 6-phosphate (G6P) and “catalytic” NADP+ (NADP+c), as well as a “structural” NADP+ (NADP+s) located ∼25 Å from the active site, to generate NADPH. While X-ray crystallographic and biochemical studies have revealed a role for NADP+s in maintaining the catalytic activity by stabilizing the multimeric G6PD conformation, other potential roles for NADP+s have not been evaluated. Here, we determined the high resolution cryo-electron microscopy structures of human wild-type G6PD in the absence of bound ligands and a catalytic G6PD-D200N mutant bound to NADP+c and NADP+s in the absence or presence of G6P. A comparison of these structures, together with previously reported structures, reveals that the unliganded human G6PD forms a mixture of dimers and tetramers with similar overall folds, and binding of NADP+s induces a structural ordering of a C-terminal extension region and allosterically regulates G6P binding and catalysis. These studies have implications for understanding G6PD deficiencies and for therapy of G6PD-mediated disorders.
한글 초록 : 인간 glucose-6-phosphate dehydrogenase(G6PD)는 세포 내 NADPH의 주요 공급원이며, 따라서 환원형 글루타티온 유지에 핵심적 역할을 수행하여 용혈성 빈혈과 같은 산화스트레스관련 질환으로부터 세포를 보호하는 데 중요함. G6PD는 다중체 효소로서 β-D-glucose 6-phosphate(G6P)와 ‘촉매’ NADP⁺(NADP⁺c)를 보조인자로 사용하며, 활성부위에서 약 25 Å 떨어진 위치에 존재하는 ‘구조적’ NADP⁺(NADP⁺s)도 함께 이용하여 NADPH를 생성함. 기존 X선 결정학 및 생화학 연구에서 NADP⁺s는 G6PD의 다중체 구조를 안정화하여 촉매활성을 유지하는 역할이 제시되었으나, 그 외 가능한 역할은 충분히 평가되지 않았음. 본 연구에서는 리간드가 결합되지 않은 상태의 야생형 인간 G6PD와, 촉매 결함 변이(G6PD-D200N)가 NADP⁺c와 NADP⁺s에 결합한 상태(또는 여기에 G6P가 존재/부재하는 상태)의 고해상도 cryo-EM 구조를 규명함. 이들 구조를 기존 보고 구조들과 비교한 결과, 리간드가 없는 인간 G6PD는 전체 접힘이 유사한 dimer와 tetramer의 혼합체를 형성함을 확인함. 또한 NADP⁺s 결합이 C-말단 연장 영역의 구조적 정렬(ordered state)을 유도하며, 이를 통해 G6P 결합과 촉매 반응을 알로스테릭하게 조절함을 제시함. 이러한 결과는 G6PD 결핍증의 이해와 G6PD 매개 질환의 치료 전략 수립에 시사점을 제공함.
Introduction : 인간 G6PD는 오탄당인산경로의 첫 단계이자 속도결정 단계를 촉매하여 G6P를 6-
phosphoglucono-lactone으로 전환시키는 동시에 NADP⁺를 NADPH로 환원시키는 효소이며, 생성된 NADPH는 환원형 글루타티온 유지 등을 통해 세포를 산화스트레스로부터 보호하는 데 핵심적임. G6PD 결핍은 X-연관으로 나타나는 가장 흔한 효소 결핍 질환 중 하나로 산화제(약물, 잠두콩 등) 노출 시 용혈성 빈혈을 유발할 수 있고, 특히 미토콘드리아가 없어 NADPH를 G6PD에 크게 의존하는 적혈구에서 취약성이 큼. 또한 G6PD 변이가 말라리아 저항성과 연관될 수 있으며, 반대로 G6PD 과발현은 암과의 관련성도 보고되어 G6PD의 활성 조절이 질환 맥락에서 중요함을 시사함. 기존 구조·생화학 연구에 따르면 인간 G6PD는 dimer of dimers 형태의 tetramer로 존재하고 각 서브유닛은 촉매 NADP⁺(NADP⁺c) 결합을 담당하는 N-말단 도메인과 구조적 NADP⁺(NADP⁺s) 결합을 담당하는 C-말단 도메인으로 구성되며, G6P는 NADP⁺c 근처의 도메인 경계에 결합하는 것으로 알려져 있음. 그러나 불활성화 변이들이 NADP⁺s 결합부위에 다수 분포하면서도 G6P 결합에 장거리 영향을 준다는 보고가 있어 그 분자 기전이 불충분하게 규명되어 있고, 용액에서 monomer/dimer/tetramer 평형 및 tetramer 활성 우위 보고 등으로 다중체화와 NADP⁺s의 역할에도 의문이 남아 있음. 더불어 기존 고해상도 구조가 주로 X선 결정학에 의존해 결정 포장 효과가 다중체 특성 해석을 왜곡할 가능성이 있으므로, 본 연구에서는 리간드가 없는 야생형과 촉매 결함 변이(D200N)를 이용해 NADP⁺c·NADP⁺s 및 G6P 유무 조건에서의 cryo-EM 구조를 규명하고 비교함으로써 G6PD의 다중체화와 NADP⁺s의 알로스테릭 역할을 이해하고자 함.
Materials and Methods : 재조합 인간 G6PD(WT) 및 촉매 결함 변이체(D200N)를 E. coli BL21(DE3)에서 발현하고 C-말단 His-tag 기반으로 코발트 레진 정제 후 gel filtration(Superdex 200)으로 추가 정제하여 cryo-EM 및 활성 분석에 사용함. 효소 활성은 상용 colorimetric assay(Abcam)로 96-well에서 반응 후 A600 흡광도로 측정하여 WT와 D200N 활성을 비교함. cryo-EM은 WT 단백질을 약 0.8 mg/mL로 그리드 제작하였고, D200N은 NADP⁺(3 mM) 및 G6P 농도(3 mM 또는 100 mM)를 달리하여 인큐베이션한 뒤 구조를 얻어, 낮은 G6P에서는 NADP⁺만 관찰, 높은 G6P에서는 NADP⁺와 G6P 모두 관찰되도록 조건을 설정함. 데이터는 Titan Krios(K3 detector 등)로 수집하고, 처리 과정에서 MotionCor2로 모션 보정 후 Cryosparc2 기반으로 정제/재구성하며 Ctffind4로 CTF 평가하여 품질이 낮은 마이크로그래프를 제외함.
Results :
3.1 리간드 없는 WT G6PD의 올리고머 상태(dimer/tetramer) 규명
- cryo-EM 분석에서 WT G6PD가 dimer와 tetramer가 혼재하는 상태로 관찰됨.
- dimer와 tetramer는 전체 접힘에서 구조 차이가 거의 없고(rmsd ~0.83 Å), 형태만 달리 존재함을 제시함.
3.2 촉매 결함 변이(D200N)로 “반응 전” 결합 상태 포획
- 반응이 진행되지 않은 상태에서 리간드 결합 구조를 잡기 위해 D200N 변이체를 사용함.
- D200N은 gel filtration 프로파일이 WT와 유사하여 접힘/조립은 유지되나 촉매 활성은 유의하게 감소함을 확인함.
3.3 NADP⁺/G6P 결합 조건에 따른 cryo-EM 복합체 구조 확보
- D200N에 리간드를 처리하여 (i) NADP⁺s + NADP⁺c 결합 상태(무 G6P), (ii) NADP⁺s + NADP⁺c
+ G6P 결합 상태의 구조를 각각 고해상도로 획득함.
- 리간드 결합 여부가 전체 골격을 크게 바꾸지 않음을 구조 비교로 제시함.
3.4 NADP⁺s 결합이 유도하는 구조 변화: C-말단 정렬 및 G6P 결합부위 재배치
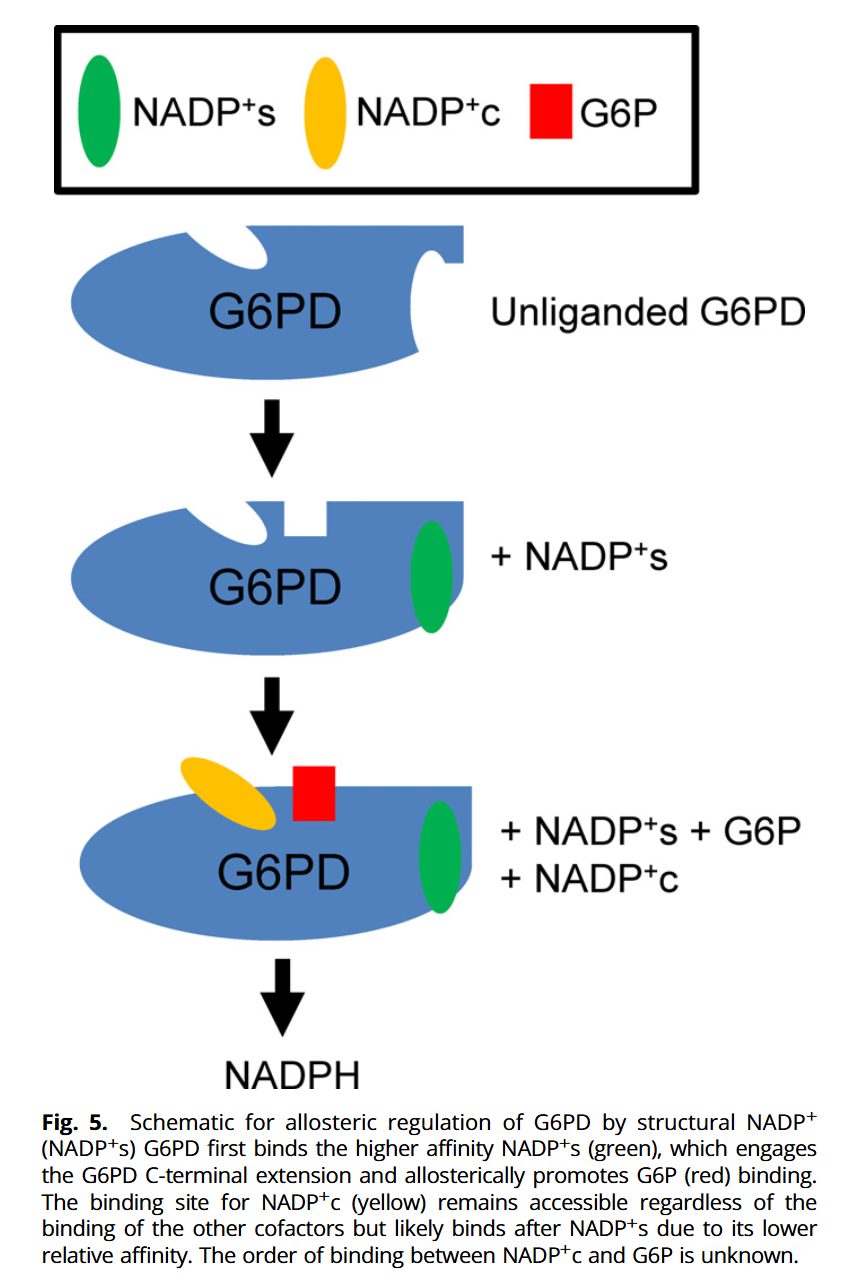
- NADP⁺s 결합 시 C-말단 연장부가 구조적으로 정렬(ordered)되는 특징이 관찰됨(리간드 없는 상태에서는 해당 구간이 잘 정해지지 않음). 더 중요한 기능적 변화로, NADP⁺s 결합이 구조 신호를 전달하여 201–205 루프가 짧은 f′ helix로 전환되고 His201/Tyr202/Lys205 등이 G6P 결합에 유리한 위치로 이동함을 제시함.
3.5 NADP⁺c 결합부위는 비교적 보존됨: NADP⁺s와의 독립성 시사
비교 구조에서 NADP⁺c 결합부위는 NADP⁺s 유무에 따라 큰 변화가 거의 없음을 보여, NADP⁺c
결합은 상대적으로 독립적일 가능성을 시사함.
Discussion : 본 연구는 (1) 리간드 없는 인간 G6PD 구조와 (2) D200N을 이용한 “완전 리간드 결합(=NADP⁺c, NADP⁺s, G6P)” 상태 구조를 cryo-EM으로 규명하여, 리간드 없는 상태에서 dimer/tetramer 혼재 및 NADP⁺s 결합 시 C-말단 연장부가 구조화되며 G6P 결합/촉매가 알로스테릭하게 조절됨을 통합적으로 제시함. 특히 NADP⁺s가 결합하면 C-말단 도메인 β-sheet 재배치가 G6P 결합부위(201–205)의 재정렬로 전파되어 G6P 결합과 촉매를 촉진한다는 모델을 제안하며, NADP⁺c 결합부위는 큰 변화가 없어 NADP⁺c는 독립적으로 결합 가능하나 친화도 차이로 NADP⁺s 이후에 결합할 가능성을 언급함. 아울러 결합 순서에 대해서는 NADP⁺s가 먼저 결합해 C-말단 연장부를 잡고 G6P 결합을 촉진하며, NADP⁺c 자리 접근성은 유지되나 상대 친화도 때문에 뒤따를 수 있고, NADP⁺c와 G6P 중 무엇이 먼저인지는 불명이라고 정리함.




댓글